|
盘点 | 2019年3月全球获批新药情况
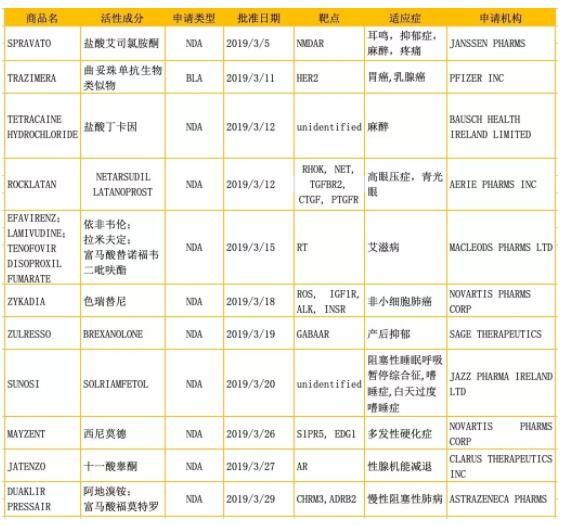
根据火石创造数据库数据显示,截至2019 年 3月FDA共批准94个药品上市,其中NDA药品为10个,BLA药品为1个,ANDA药品为83个。NDA和BLA药品在FDA获批情况见表1。
在批准的10种NDA品种中,西尼莫德、BREXANOLONE和SOLRIAMFETOL为新分子实体(NME)品种,即如今国内的1类新药。
在FDA的注册审评审批中,新药申请(NDA)包括505(b)(1)和505(b)(2)。505(b)(1),即独立NDA(stand-alone NDA),申报难度最高,注册申请资料中需包括完整的安全性和有效性研究报告,且这些报告均来自于申请者或者申请者有使用它的权利。
其中505(b)(2)途径主要是为了支持批准已上市药物的新的适应症、给药途径或缓释剂型,允许 FDA 依赖不是由NDA申请人研发的数据,可用于应对专利悬崖和市场竞争并相对仿制药具有较丰厚的市场回报,例如,孤儿药物的505(b)(2)申请可得到7年独占权,新化学实体-NCE的505(b)(2)申请可得到5年独占权。
根据火石创造数据库和多家药企官方公开数据统计,2009 — 2015 年 在451 件 FDA 原始 NDA 批准中,505(b)(2) 申请284件,占63%。FDA 在 505(b)(2) 路径之外,批准了 NME NDA 167 件 。在欧洲,类似于505(b)(2)途径的是2001/83/EC号指令第10条的综合程序;在中国,类似于505(b)(2)途径的是改良型新药,即2类药。
此前,2006年《药品注册管理办法》界定:新药,是指未曾在中国境内上市销售的药品。
2016 年 3 月国家食品药品监督管理总局发布《关于发布化学药品注册分类改革工作方案的公告》( 2016 年第 51号) 将化药新药分为创新药和改良型新药,创新药定义为“first-in-class”的药物,即全新化合物、且靶点也是新的,即1类新药,可认为是之前的1.1类新药。
至此,拉开促进医药产业转型升级,提高药品质量,解决注册申请积压,鼓励新药研究和创制的帷幕,我国新药研发启动由单纯仿制(1.0 版)向 me too 和专利引进(2.0 版)以及自主创新、与海外同步发展(3.0 版)升级通道。
根据火石创造数据库数据显示,截至2019年3月31日,从1类化学创新药(新1类+旧1.1类新药)注册申报数量来看,国内产品临床申报数量TOP 3是恒瑞医药、广东东阳光和江苏豪森药业。此外,和正大天晴药业集团股份有限公司、中国科学院上海药物研究所、北京诺华制药有限公司、诺华(中国)生物医学研究有限公司、山东轩竹医药科技有限公司、贝达药业股份有限公司、和记黄埔医药(上海)有限公司申报数量也超过了20个。
江苏恒瑞医药已有3个1类化学创新药成功上市,目前研发管线状态为3个处于NDA状态,6个处于临床III期,4个处于临床II期,7个处于临床I期,2个处于IND申报阶段。pipeline研究领域主要包括肿瘤、内分泌代谢和心血管疾病等;广东东阳光目前临床在研1类化学创新药为17个处于临床I期,1个处于临床III期,pipeline研究领域主要覆盖肿瘤、感染性疾病和呼吸系统疾病等。
江苏豪森已有2个1类化学创新药成功上市,目前研发管线状态为2个处于NDA状态,5个处于临床III期,3个处于临床II期,11个处于临床I期,3个处于临床IND申报阶段,pipeline研究领域主要也是覆盖肿瘤、内分泌代谢和感染性疾病等。
原文详见链接:
https://www.yigoonet.com/article/22357705.html